研究室 紹介
■ 研究室
応用分子画像科学分野(大学院医理工学院)
■ 研究内容紹介
【1】がん治療におけるPrecision Medicineを目指した分子イメージング法の開発
【2】慢性炎症性疾患診断のためのバイオマーカー探索・イメージング技術の開発研究
【3】新しい生理機能の解明を目指したイメージング質量分析法(IMS)の開発
応用分子画像科学分野(大学院医理工学院)
当分野では、分子イメージング(画像診断)・治療に用いる新しい分子プローブの研究開発、すなわち、機能分子の探索、プローブのデザイン、プローブ合成技術、合成装置の開発、臨床へのトランスレーション等に関する研究を行っています。
― 主なテーマ ―
- 病態評価、治療効果判定、治療戦略の観点から、分子、細胞の機能的変化の判定や治療に適した分子、すなわち病態分析・イメージング・治療の標的分子を探索する研究
- 各種疾患の病態に関与する因子(酵素・受容体など)の分子レベルの機能を解明し、診断・治療に繋げうる新しい分子プローブの創製研究
- 分子プローブの合成・製造技術の開発と診断・治療へのトランスレーション研究
- 分子画像診断技術を先端創薬技術と融合させることにより、疾患の治療効果や体内での薬の動きを正確に捉えることができる新たなイメージング技術を創製する研究
- ラジオトレーサー法による薬物の体内動態解析に基づく治療効果判定の解析・副作用の予測に関する研究
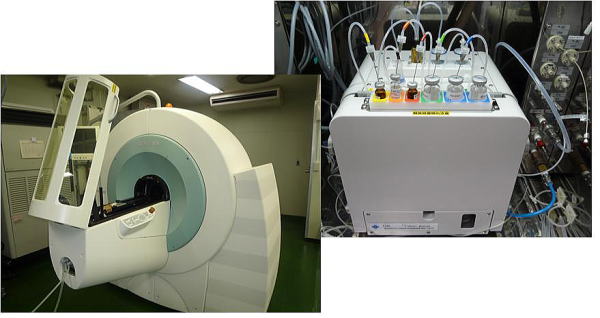
図 アイソトープ総合センターに導入された動物用イメージング装置(PET/SPECT/CT)と
北大病院に導入されたプローブ(18FDG)合成装置
研究内容 紹介
【1】がん治療におけるPrecision Medicineを目指した
分子イメージング法の開発
~ (1) チミジンホスホリラーゼを標的とした新規イメージング剤の開発 ~
チミジンホスホリラーゼ(TP)はチミジンをチミンと2-デオキシ-D-リボース-1-リン酸に可逆的に変換する酵素であり、その酵素活性は、腫瘍の血管新生、浸潤、転移と関連がある。このことから、TP発現を画像化できれば腫瘍の悪性度の評価ができると考えられる。また、TPの酵素活性は抗がん剤である5-フルオロウラシル(5-FU)や5-FUのプロドラッグであるドキシフルリジン、カペシタビンの活性化にも関与していることから、これらの抗がん剤の効果予測への応用も期待できる。そこで我々は、腫瘍に発現するTPを体外から高感度で検出・画像化する診断法を確立することを目的として、TPと高い親和性を有する化合物([123I]IIMU)を設計・合成し、細胞・動物等を用いた前臨床研究により、その有効性を実証した。また、[123I]IIMUの安全性試験を終え、北海道大学病院にて、[123I]IIMU注射薬を用いたFirst-in-Human臨床研究を実現した。
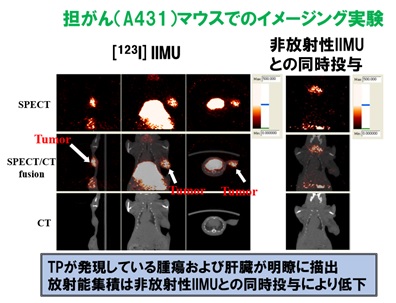
図1 担がん(A431)マウスでのTPイメージング画像
【 論 文 発 表 】
1. Takahashi M, Seki K, Nishijima K, et al.: J Label Compd Radiopharm.
2008; 51: 384-387.
2. Akizawa H, Zhao S, Takahashi M, et al.: Nucl Med Biol. 2010; 37: 427-432.
3. Li H, Zhao S, Jin Y, et al.: Nucl Med Commun. 2011; 32: 1211-1215
4. Zhao S, Li H, Nishijima K et al.: Ann Nucl Med. 2015; 29: 582-587.
5. Kobashi N, Matsumoto H, et al.: The Thymidine Phosphorylase Imaging
Agent 123I-IIMU Predicts the
Efficacy of Capecitabine. J Nucl Med. 2016;57(8):1276-81.
6.Watanabe S, Nishijima K, Okamoto S, et al.: Ann Nucl Med. 2020; 34: 595-599.
~(2) 新規低酸素PETイメージング剤[18F]DiFAの開発~
1) 臨床応用にむけたトランスレーション研究
腫瘍内の低酸素は、放射線感受性の低下やHIF-1の発現により、放射線や化学療法に対し抵抗性を示すことが知られている。従って、放射線治療の部位の決定や効果予測、抗がん剤の選択など個々の腫瘍への個別化医療を実現するために、非侵襲的な低酸素イメージング法の開発が必要である。[18F]FMISOは代表的なニトロイミダゾール誘導体低酸素PETイメージング剤であるが、その遅い生体クリアランスから、腫瘍内低酸素領域の良好なコントラストが得られるまでに時間がかかることが問題であった。そこで我々は、[18F]FMISOの構造の一部を改変した[18F]DiFAを合成した。移植腫瘍モデルを用いて、低酸素領域への集積をPETイメージングにて検討したところ、[18F]FMISOに比較して、投与後早期に腫瘍内低酸素を描出できることを明らかにした (1)。また、医学研究院核医学教室との共同研究により、健常人での安全性試験を完了し、北海道大学病院にて、[18F]DiFA注射薬を用いたFirst-in-Human臨床研究を実現した(2)。
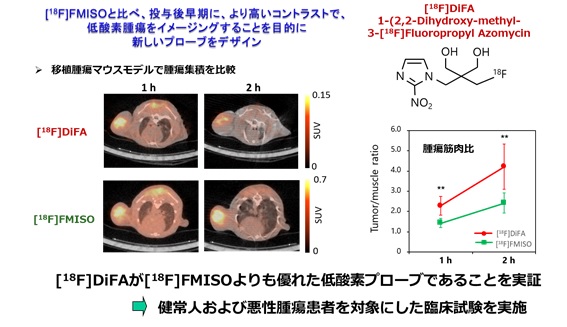
図2 低酸素プローブ[18F]DiFAと[18F]FMISOの腫瘍内分布および腫瘍筋肉比の比較
【 論 文 発 表 】
1. Shiro Watanabe; Tohru Shiga; Kenji Hirata, et al. EJNMMI Research. 2019;
in press.
2. Yasui H, Zhao S, Higashikawa K, et al. J Nucl Med. 2017;58:1027.
2) [18F]DiFAの低酸素腫瘍への集積メカニズムの解明
[18F]FMISOや[18F]DiFAといったニトロイミダゾール誘導体の低酸素領域への集積は、腫瘍内低酸素領域で特異的に還元された後、生体内高分子と共有結合することによると考えられてきた。しかしながら集積部位における化学形態は明らかにされてこなかった。我々は、組織切片上における低分子の分布を直接可視化できる手法であるイメージング質量分析技術(IMS)を用いて、腫瘍低酸素領域内における[18F]FMISOや[18F]DiFAの化学形態およびその分布を評価した。その結果、従来想定されてきた生体内高分子への共有結合に加え、アミノ還元代謝物のグルタチオン抱合体がこれらプローブの低酸素領域への集積に大きく関与する可能性が示された(1,2,3)。同様に低酸素領域に集積する性質を有し、組織切片上での低酸素プローブとして用いられるpimonidazoleについても、還元型pimonidazoleのグルタチオン抱合体が低酸素領域と一致して存在することを明らかにした(4)。これらの研究は、ニトロイミダゾール系化合物の低酸素領域への集積機序に新しい知見を与えるものであり、より特異的な低酸素イメージング剤や低酸素標的治療薬の開発に役立つと考えられる。
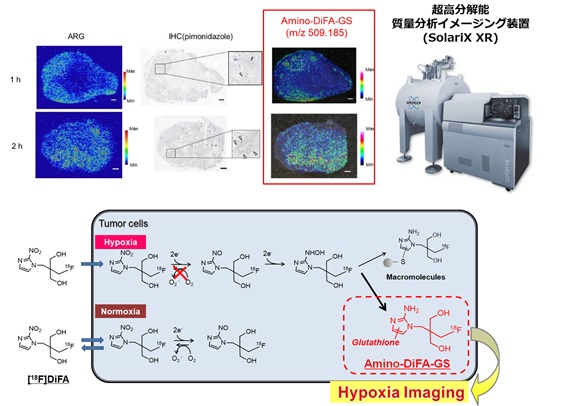
図3 IMSを用いた低酸素プローブ[18F]DiFAの腫瘍内集積の解析と
核医学イメージング像を反映すると推測される化学形態
【 論 文 発 表 】
1. Masaki Y, Shimizu Y, Yoshioka T et al. Sci Rep. 2015;5:16802.
2. Masaki Y, Shimizu Y, Yoshioka T et al. PLoS One. 2016;11(8):e0161639.
3. Masaki Y, Shimizu Y, Yoshioka T et al. Ann Nucl Med. 2017;31(8):596-604.
4. Shimizu Y, Zhao S, Yasui H, et al. Mol Imaging Biol. 2019;21(1):122-129.
~ (3) フェロトーシス誘導剤を用いたがん治療法の開発とその治療効果予測を可能とする
イメージング剤の開発 ~
フェロトーシスとは、近年報告された新しいタイプの細胞死様式であり、細胞内に鉄が異常蓄積することで生じた活性酸素種が、細胞を傷害することで生じる。がん細胞は抗酸化活性を高めることでこのフェロトーシスを回避しているが、この抗酸化活性を抑制し、フェロトーシスを人為的に誘導する薬剤が新たながん治療法として注目されている。一方、体外から放射線をがんに照射し、がん細胞を死滅させる放射線治療は、がんの三大療法の一つとして確立された治療法である。そこで我々はそれぞれの治療法の相乗効果を期待し、フェロトーシス誘導剤と放射線治療の併用療法による治療効果を評価した。その結果、がん移植モデルマウスを用いた実験において、フェロトーシス誘導剤と放射線照射の併用療法は、フェロトーシス誘導剤単独もしくは放射線照射単独に比べ、有意にがんの増殖を抑制した。以上の結果から、フェロトーシス誘導剤と放射線照射の併用療法は、放射線治療抵抗性のがんに対する新たな治療法になり得ると考えられる。一方で、フェロトーシス誘導剤に対する感受性は、がん細胞の種類によっても異なることが知られている。そこで我々は、個々の患者に合わせた最適な治療の実現に向け、フェロトーシス誘導剤への感受性予測を可能とする、新たな分子プローブの開発にも現在取り組んでいる。
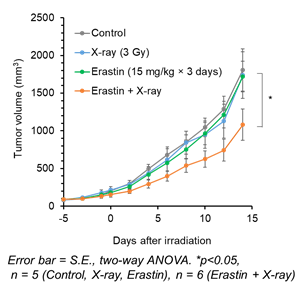
図4 がん移植モデルマウスにおけるフェロトーシス誘導剤単独 (緑色)、放射線照射単独 (青色)、併用療法 (オレンジ色) のがん増殖抑制効果
【 論 文 発 表 】
1. Shibata Y, Yasui H, Higashikawa K et al. PLos ONE. 2019;14:e0225931.
~ (4) 多価ペプチドを母体としたがんイメージング剤の開発 ~
多価効果とは、標的への結合部位を複数有する多価化合物が、1つのみ有する1価化合物に比べより高い結合力を示す現象のことを指す。我々はこの多価効果という現象を利用し、新たながんイメージング剤の開発を進めている。例えば、integrin αvβ3は多くの種類のがん細胞において過剰発現し、その発現量はがんの悪性度と相関することが知られている。そのため、このintegrin αvβ3に対し高い親和性と特異性を有しているRGDペプチドを母体としたイメージング剤は、がんの早期発見や予後予測に貢献できると考えられる。しかし、1価RGDのintegrin αvβ3への結合親和性はイメージング剤としては不十分であり、明瞭ながんの画像が得られないという問題があった。そこで我々は、SPECT用核種である99mTcに複数のRGDを導入した99mTc標識多価RGDを合成し、その有用性を評価した。その結果、新たに作製した99mTc標識多価RGDは1価RGDに比べ約10倍高い結合親和性を示し、がん移植モデルマウスにおいても、がん組織への高い集積が観察された。これらの結果は、integrin αvβ3に限らず、様々な生体分子を標的としたイメージング剤の開発においても、多価効果の利用が有効であることを示唆している。更に近年では、核医学診断と核医学治療を一体化したRadiotheranosticsへの展開も見据え、多価ペプチドの構造を最適化することで、がんへの集積性と滞留性をより高めたRI標識化合物の開発を進めている。
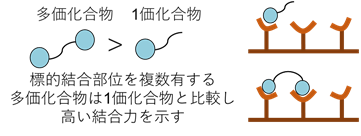
図5 多価効果の概念図
【 論 文 発 表 】
1. Mizuno Y, Uehara T, Hanaoka H et al. J Med Chem. 2016;59:3331.
2. Mizuno Y, Uehara T, Jen CW et al. RSC Adv. 2019;9:26126.
3. Mizuno Y, Komatsu N, Uehara T et al. Nucl Med Biol. 2020;86-87:30.
【2】慢性炎症性疾患診断のためのイメージング技術の開発研究
~(1) 非アルコール性脂肪肝炎(NASH)診断のための核医学診断法の開発研究~
肝生検は、非アルコール性脂肪肝炎 (NASH) の診断法としてGold Standardではある。しかしながら、侵襲性が高く苦痛を伴う、採取する生検サンプルが肝臓に対してごく微量であり結果がばらつきやすい等の問題点があり生検に代わる診断法の確立が望まれている。そこで、我々は、非侵襲的かつ肝臓全体を一度に評価できる核医学イメージングを用いたNASH診断法の開発を進めている。 我々は代表的なNASHモデルであるメチオニン・コリン欠乏食誘発NASHモデル動物を用いて、NASHのバイオマーカー探索を実施した。その結果、チミジンホスホリラーゼ (TP) の発現量がNASHになると減少することを見出した。さらに、TPの肝臓内分布は、 正常肝では一様に分布しているのに対し、NASHモデルの肝臓ではまだらに分布することも発見した。そこで、NASHモデルを用いて上述のTPイメージング剤([123I]IIMU)のSPECT/CT撮像を行ったところ、TP発現と同様にNASHモデルの肝臓では本薬剤の集積が有意に減少していた。また、[125I]IIMUをNASHモデルに投与し、その肝臓内分布とTPの発現分布を比較したところ、[125I]IIMUの肝臓内分布と TPタンパク質発現分布は一致していた。これらの研究は、[123I]IIMUを用いた核医学診断により、肝臓中のTPの発現量および局在を捉えることで、非侵襲的にNASHの診断を行える可能性を示すものである。
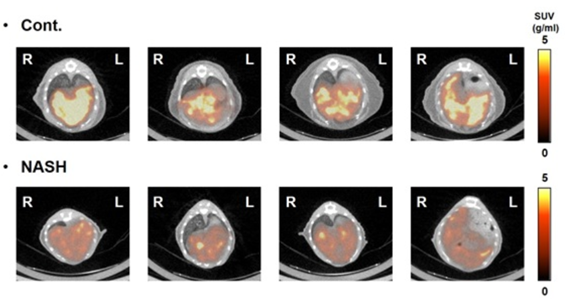
図6 NASHモデルおよびコントロールマウス肝臓の[123I]IIMU SPECT/CT画像
【 論 文 発 表 】
1. Higashikawa K, Horiguchi S, Tarisawa M, et al.: Nucl Med Biol. 2020; 82-83: 25-32.
【3】新しい生理機能の解明を目指した
イメージング質量分析法(IMS)の開発
~(1) スフィンゴミエリン分子種の組織内分布可視化~
スフィンゴミエリン(SM)は生体膜の構造維持やシグナル伝達において非常に重要な役割を持つスフィンゴ脂質である。SMは分子内の脂肪酸鎖長により複数の分子種が存在するが、各SM分子種の組織内分布や生理機能の違いは不明な点が多い。これまでに、我々はIMS技術を用いて各SM分子種の脳組織内分布および定量化を行い、C18長鎖アシル基を持つSM (d18:1/18:0)は主に細胞体が豊富な灰白質に分布し、C24極長鎖アシル基を持つSM (d18:1/24:1)は主に髄鞘が豊富な白質に分布することを明らかにした。また、SMの前駆体であるセラミドの合成を司るCerSの遺伝子発現分布との比較によって、分子種ごとに異なるSMの組織内分布がCerSの発現によって制御されている可能性を示した(1)。次にSM合成酵素の一つであるSMS2の欠損による各組織におけるSMの量的・空間的変動を調べたところ、SMS2 KOマウスの肝臓および腎臓ではC22-およびC24-SMが減少していた。さらに、SMS2の欠損によって腎機能には変化が無かったが、肝臓における脂肪蓄積や脂肪酸合成遺伝子の発現が有意に減少したことから、部位特異的なSMS2の役割が示唆された(2)。一方で、肝細胞特異的なSMS2 KOマウスの解析から、SMS2欠損による脂肪肝やインスリン抵抗性の改善作用は,SM非依存的なメカニズムに基づいている可能性があることを示した(3)。
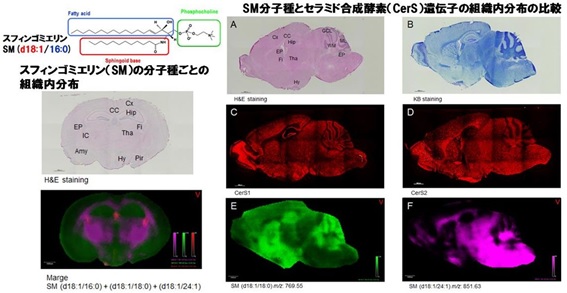
図 脳組織におけるスフィンゴミエリン(SM)分子種の組織内分布とセラミド合成酵素(CerS)遺伝子発現との関連
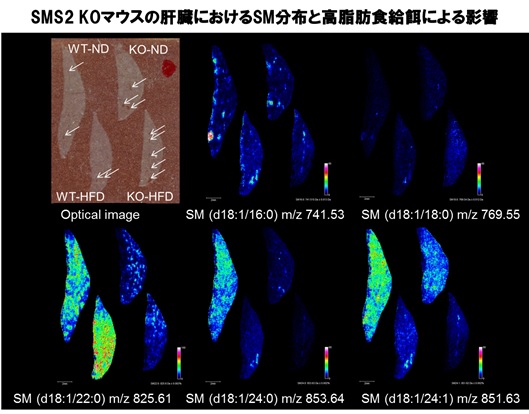
図 肝臓におけるスフィンゴミエリン(SM)分子種の分布に対する高脂肪食給餌の影響とSMS2発現による違い
【 論 文 発 表 】
1. Sugimoto M, Shimizu Y, Zhao S, et al. Biochim Biophys Acta. 2016; 1861(8
Pt A): 688-702.
2. Sugimoto M, Wakabayashi M, Shimizu Y, et al. PLoS One. 2016; 11(3):
e0152191.
3. Sugimoto M, Shimizu Y, Yoshioka T, et al. Biochim Biophys Acta. 2015;
1851(12): 1554-65
北海道大学
アイソトープ総合センター
〒060-0815
北海道札幌市北区北15条西7丁目
TEL:011-706-6088(管理室)
TEL:011-706-6087(事務室)
FAX:011-706-7862