2021年7月16日
ポイント
●アルギニンがプレニル化された環状ペプチドを藍藻から発見。
●アルギニンをプレニル化する新規酵素の機能を解明。
●プレニル化によって抗菌性を高めることが可能。
概要
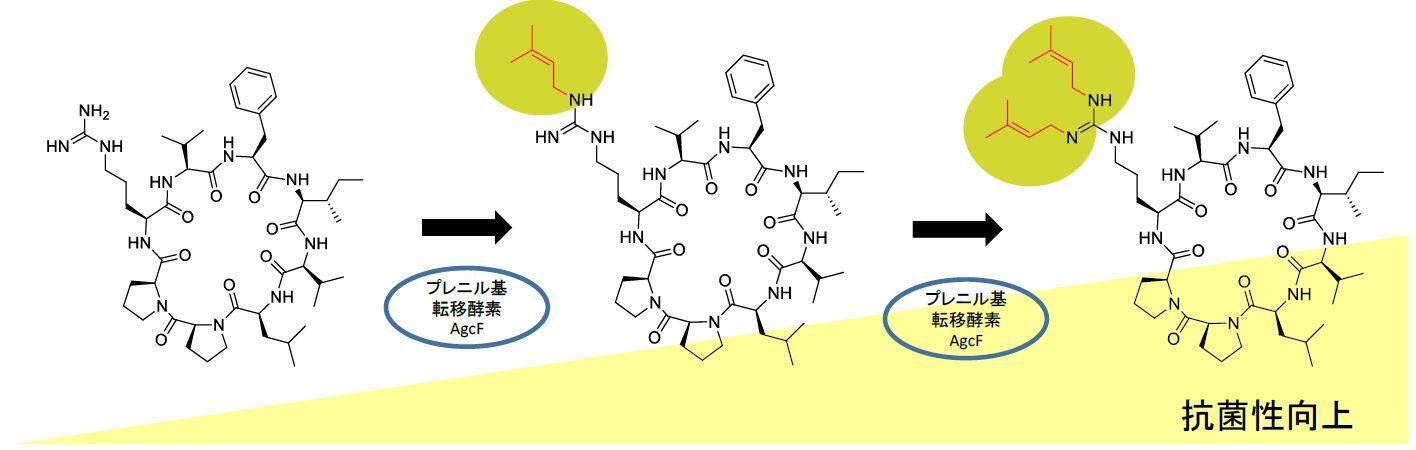
北海道大学大学院地球環境科学研究院の沖野龍文教授と薬学研究院の松田研一助教、脇本敏幸教授らの研究グループは,多剤耐性菌などに対する抗菌活性を示す環状ペプチドのアルギシクラミド類を,湖沼にアオコを形成する藍藻から発見しました。環状ペプチドに含まれるアミノ酸アルギニンのグアニジン部分の窒素にプレニル基が2個結合していることが構造の特徴です。ペプチド中のアルギニンをプレニル化する酵素は明らかにされていなかったため,研究グループは,この藍藻の遺伝子解析を行い,アルギシクラミド類の生合成酵素の解明に取り組みました。
その結果,AgcFと名付けたプレニル基転移酵素を見いだしました。化学合成したプレニル基をもたないアルギシクラミドCとの酵素反応を試みた結果,プレニル基1個のアルギシクラミドBを経て,プレニル基2個で抗菌性をもつアルギシクラミドAに変換することが確認されました。アルギシクラミドCのアルギニンの代わりに,トリプトファンやリシンなどの異なるアミノ酸に置換した化合物や,アルギシクラミドCと同じアミノ酸配列でありながら環化していない直鎖の化合物を合成して,AgcFとの酵素反応を試みましたが,プレニル化は進みませんでした。一方,プレニル基が2個つながったゲラニル基を取り込むことも,この酵素は可能でした。この酵素の立体構造を予測したところ,活性部位の入り口部分が類似の酵素に比べて広くて,より大きなゲラニル基を取り込めると予想されました。
分子量500~2,000の中分子は新しい医薬品の候補として期待されています。本研究で発見した環状ペプチドもその範疇に入りますが,一般に生体膜を通過しにくく細胞内に入り込めないという問題があります。プレニル化は、脂溶性を高めて生体膜を通りやすくすることができます。実際,プレニル基が2個結合したアルギシクラミドAが最も高い抗菌性を示しました。本研究で発見したプレニル基転移酵素を使って,医薬品候補環状ペプチドのアルギニンをプレニル化することでその効果を高めて実用化を目指すことが期待されます。
なお,本研究成果は,2021年6月28日(月)公開のJournal of the American Chemical Society誌に掲載されました。
詳細はこちら