2023年6月26日
ポイント
●NMR法を用いて、Mincleの糖脂質認識機構を解明。
●Mincleの糖脂質認識部位は揺らいだ構造を持っていることが判明。
●効果的な免疫賦活剤(アジュバント)の開発に期待。
概要
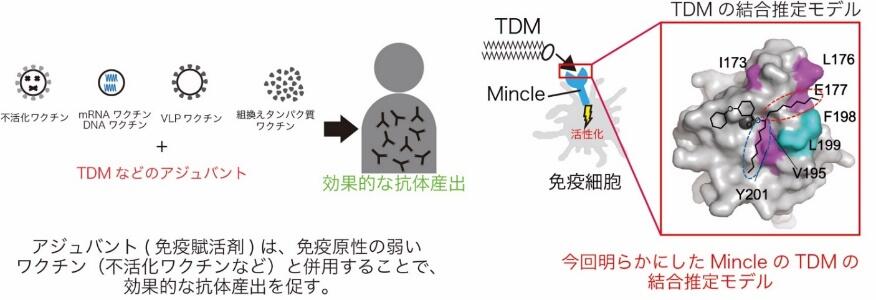
北海道大学大学院薬学研究院の前仲勝実教授、古川 敦助教(現・金沢大学医薬保健研究域薬学系准教授)らの研究グループは、北海道科学大学薬学部の齊藤貴士准教授、大阪大学微生物病研究所の山崎 晶教授らと共同で、免疫賦活剤(アジュバント)となる結核菌の表面に存在するトレハロースジマイコレート(TDM)など幅広い糖脂質を認識し、免疫の活性化に関わるMincleの糖脂質認識機構を明らかにしました。
Mincle(Macrophage inducible C-type lectin)は免疫細胞の表面に発現するタンパク質です。結核ワクチンとして知られるBCGワクチンに含まれ、免疫活性化効果のある結核菌由来の糖脂質とMincleが結合して免疫活性を引き起こし、病原体を排除します。研究グループはこれまでにX線を用いてMincleの結晶構造を解明し、糖脂質認識機構を推定していましたが、糖脂質が結合したMincleの構造や、Mincleが糖脂質を認識する機序は不明でした。そこで研究グループは、Nuclear Magnetic Resonance(NMR)法を用いて、Mincleの糖脂質認識機構を明らかにすることを目指しました。
NMR法によってMincleタンパク質の立体構造を解析した結果、溶液中のMincleは、揺らぎが大きい構造を取っていることが解明されました。Mincleの糖脂質の結合部位を明らかにするために、水溶性の高い1本鎖の脂質を持つ糖脂質を滴下し、Mincleの化学シフト変化を観測しました。その結果、糖脂質の結合により、糖の結合部位を中心として幅広い範囲のアミノ酸で化学シフト変化を示すことが分かりました。糖部分のみの添加では、糖脂質ほど広範囲のアミノ酸での化学シフト変化は起こらなかったことから、脂質の結合部位が広範に渡っていることを示唆しました。Mincleを介した細胞の活性化能が強い2本鎖の脂質でも同様の結果かELISA法を用いて検証しました。その結果、2本鎖の糖脂質の結合では、脂質部分の結合1本鎖で結合に関与が示唆されたアミノ酸に加え、他のアミノ酸が関与していることが示唆されました。この結果は、2本鎖の脂質部分に結合した部位に化合物が結合するように設計することが、効果的なアジュバントのために重要であることを示唆します。
なお、本研究成果は、2023年6月21日(水)公開のStructure誌に掲載されました。
論文名:Structural basis for glycolipid recognition of the C-type lectin Mincle(C型レクチン受容体Mincleの糖脂質認識の構造学的基盤)
URL:https://doi.org/10.1016/j.str.2023.05.018
詳細はこちら