2024年6月21日
ポイント
●筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)の原因となる機構を解明。
●モデル生物である線虫を用いてTDP-43カルボキシ末端断片凝集による毒性を実証。
●ALSやFTDなど神経変性疾患においてタンパク質凝集を抑制する薬剤評価に期待。
概要
北海道大学大学院先端生命科学研究院の北村 朗講師、同大学大学院生命科学院博士後期課程3年の藤本 愛氏らの研究グループは、筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)の原因となるTDP-43カルボキシ末端断片の細胞内凝集体形成機構を明らかにするとともに、モデル生物である線虫を用いて凝集体による毒性を実証しました。本成果は、米国ノースウェスタン大学リチャード・モリモト教授らとの国際共同研究によるものです。
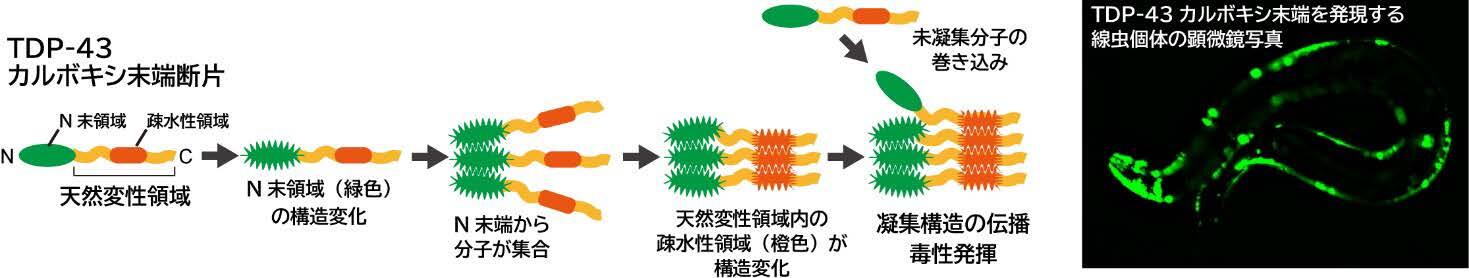
本成果では、TDP-43カルボキシ末端断片が凝集する時、どの領域がどういう推移で凝集していくのかを、ドメイン欠損変異体やドメイン交換変異体などを使って明らかにしました。具体的には、TDP-43カルボキシ末端断片のN末端ドメインが最初に構造変化した後、分子間の会合が起こります。それにより、C末端側の元来構造を取らない天然変性領域が構造変化することで、まだ構造変化していないTDP-43カルボキシ末端断片や細胞内のタンパク質を巻き込んでアミロイドを含む凝集体を形成します。
また、光により時空間を制御しつつタンパク質の会合を誘導できるタグを用いた解析により、TDP-43カルボキシ末端断片の天然変性領域のN末端側は近接しやすいのに対し、C末端側は近接しにくいことも示唆されました。さらに、有名なモデル生物である線虫にTDP-43カルボキシ末端断片を発現させると、線虫内でも凝集体を形成しますが、流動性の低い凝集体を形成する線虫では運動性の低下が起こり、短寿命となることが分かりました。将来的には、本研究で確立した手法が利用してTDP-43カルボキシ末端断片の凝集形成を抑える薬剤評価を行うことで、ALSやFTDの治療または予防戦略に期待が持たれます。
なお、本研究成果は、2024年6月20日(木)公開のCommunications Biology誌にオンライン掲載されました。
論文名:Hetero-oligomerization of TDP-43 carboxy-terminal fragments with cellular proteins contributes to proteotoxicity(TDP-43カルボキシ末端断片と細胞内タンパク質のヘテロオリゴマー形成はタンパク質毒性に寄与する)
URL:https://doi.org/10.1038/s42003-024-06410-3
詳細はこちら