2024年9月26日
ポイント
●CRISPR/Cas RNP送達に適した新たな脂質材料の開発により効率を約10倍向上。
●脂質材料の優れた生分解性により高い安全性を示す脂質ナノ粒子を構築。
●CRISPR-LNPの静脈内投与により肝臓遺伝子の98%以上のノックアウトを達成。
概要
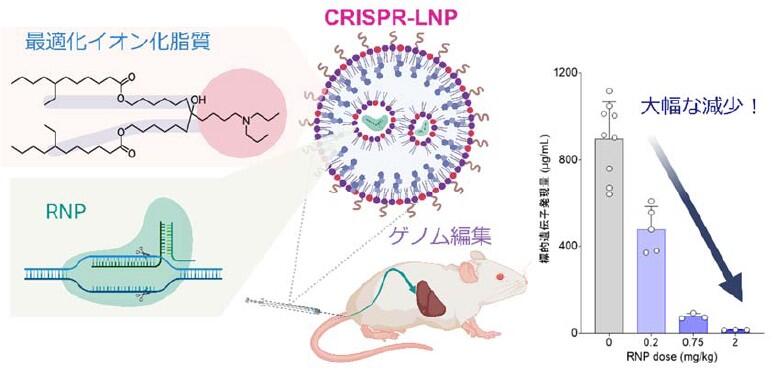
北海道大学大学院薬学研究院の佐藤悠介助教、原島秀吉教授、同大学大学院生命科学院修士課程の小沼はるの氏(研究当時)の研究グループは、ゲノム編集用脂質ナノ粒子(Lipid Nanoparticles: LNPs)の大幅な効率の改善に成功しました。
2020年にノーベル化学賞の受賞対象となったCRISPR/Casシステムは、多様な難治性疾患に対する根本的治療戦略として期待されています。しかしながら、その医薬品応用のためにはゲノム編集ツールを標的組織だけに安全かつ効率的に送達する技術が必要不可欠となります。
LNPは薬物の体内動態を制御する技術(Drug delivery system: DDS)の一つです。研究グループはこれまでに、CRISPR/Cas9タンパク質-RNA複合体(ribonucleoprotein: RNP)をLNPに封入した製剤(CRISPR-LNP)の開発に成功しています。
今回、研究グループは、CRISPR-LNPの主要な構成成分であるイオン化脂質に着目し、RNP送達に適した分子構造の最適化を図りました。最適イオン化脂質を用いて製造されたCRISPR-LNPの一度の静脈内投与により、肝臓遺伝子の98%以上のノックアウトを達成しました。また、最適イオン化脂質は優れた生分解性を示し、CRISPR-LNPは高い安全性を有することが示されました。今回開発された最適イオン化脂質の設計に基づいたCRISPR-LNPのゲノム編集治療への実用化が期待されます。
なお、本研究成果は、2024年9月20日(金)公開のiScience誌に掲載されました。
論文名:Engineering Branched Ionizable Lipid for Hepatic Delivery of CRISPR/Cas9 Ribonucleoproteins(CRISPR/Cas9 RNPの肝臓送達のための分岐イオン化脂質エンジニアリング)
URL:https://doi.org/10.1016/j.isci.2024.110928
詳細はこちら