シリーズ「人獣共通感染症との戦い」の第5回。本シリーズでは、人獣共通感染症をはじめ、その他の新興・再興感染症を制御する北海道大学の取り組みを紹介していきます。
中島 千絵(獣医学博士)(写真左)
・人獣共通感染症国際共同研究所 教授
・研究分野:結核、薬剤耐性菌
林田 京子(獣医学博士)(写真右)
・人獣共通感染症国際共同研究所 特任助教
・研究分野:アフリカ睡眠病
中島千絵さんと林田京子さんの現在の大きな使命は、安価で簡便に使用できる感染症の診断キットを開発し、発展途上国で貧困に喘ぐ人々の苦痛を少しでも和らげることです。
結核菌を研究する中島さんは、診断キットを開発し、発展途上国で検査を行なってきました。「我々の診断キットは、高価な医療機器はもとより、電気や水道もないような辺境の地でも使えるものです。貧困は、結核が広がる温床になります。途上国が豊かになり、人々の栄養状態がよくなれば、結核は撲滅できる感染症です。したがって、我々の支援は、途上国の経済状況が改善するまでということなります」。
 人獣共通感染症国際共同研究所 教授の中島千絵さん
人獣共通感染症国際共同研究所 教授の中島千絵さん世界では毎日、4,000人以上が結核で亡くなるなか、中島さんが現在注力しているのは「多剤耐性結核」の研究です。多剤耐性は、不適切な服薬中断やヒト間の感染によって発生し、全結核罹患件数の3.3パーセントを占めています。研究対象は、効き目が強いとされている2つの抗結核薬「イソニアジド」と「リファンピシン」の両方に耐性がある結核菌です。
一方、林田さんは、「アフリカ睡眠病」とも呼ばれるアフリカトリパノソーマ症(HAT)の診断キットの開発に尽力しました。HATはサハラ砂漠以南の36カ国に見られる風土病で、トリパノソーマ属の寄生原虫によって引き起こされます。吸血を通して人や動物から感染したツェツェバエが媒介することで、感染が広がります。
感染から1〜3週間の初期ステージでは、発熱や頭痛、関節痛などの症状が現れます。寄生原虫が血液脳関門(血液から脳組織への物質の移行を制限する仕組み)を越え、感染が中枢神経系に広がると第2ステージに入り、精神撹乱、神経障害などの症状が現れ、治療を施さないと死に至ります。
林田さんは、「今がHATを撲滅できるかどうかの重大な局面です。初期ステージの治療法は確立されていますので、早期に隠れたケースをあぶり出すことが大切なのです」と、診断キットの役割を指摘します。
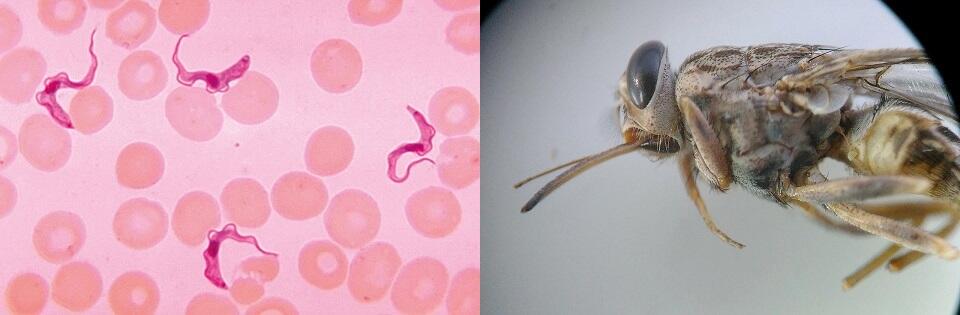 <左>赤血球の隙間に見える、睡眠病を引き起こすトリパノソーマ(CDC/Dr. Myron G.Schultz提供)
<左>赤血球の隙間に見える、睡眠病を引き起こすトリパノソーマ(CDC/Dr. Myron G.Schultz提供) <右>同感染症の媒介生物であるツェツェバエ
LAMP法を発展途上国向けに改良
林田さんは、HATの研究でザンビアを訪れることが多いそうですが、現地の感染者は症状が悪化して初めて医療機関にかかる傾向が強いといいます。分子診断が開発され、初期の感染を検出できるようになりましたが、途上国での診断には問題が少なくありません。まず、貧困層には、診断を受ける金銭的余裕がありません。また、分子診断は複雑な手順で検体を用意し、設備が整った施設で診断しなければなりませんが、発展途上国ではそのような施設が少ないのも現状です。その結果、感染者の多くはマラリアと誤診され、間違った治療法が施されてきました。
 人獣共通感染症国際共同研究所 特任助教の林田京子さん
人獣共通感染症国際共同研究所 特任助教の林田京子さんこのような診断法をめぐる課題の解決に向けて、林田さんや中島さんらは、LAMP法と呼ばれる、栄研化学株式会社が開発した核酸増幅法の技術をベースとした新たな診断キットを開発しました。林田さんは、「我々のCZC-LAMPというシステムでは、血液1滴だけで診断することができますので、費用も1回あたり1米ドル程度。最新機器も不要で、1時間ほどで結果が出ます」と、発展途上国で使用する上での同システムの有用性を語ります。
同システムは、遠隔地でも迅速に診断ができるようにLAMP法を大幅に改良したもので、試験管の中の試薬を乾燥させ、安定的に保存するためにトレハロースを使用しています。トレハロースは、試薬中の酵素や分子を「ガラス」化して閉じ込める働きをします。これにより、診断キットは常温保存ができるようになり、使用期限も延びました。林田さんは、半自動的に診断キットの試薬を乾燥させるバイオインクジェットプリンターの利用法も開発しています。
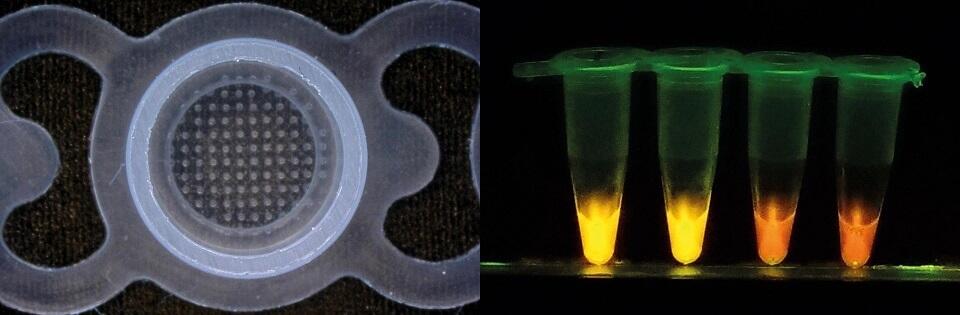 <左>試薬は試験管の蓋にバイオインクジェットプリンターを用いて滴下・乾燥させ、安定的に保存される
<左>試薬は試験管の蓋にバイオインクジェットプリンターを用いて滴下・乾燥させ、安定的に保存される <右>増幅されたトリパノソーマのDNAを含む検体は、黄蛍光色を発する
また、現地のクリニックや流行地の村々でHATの診断を行うため、診断方法を簡略化しました。この診断方法は、洗剤(界面活性剤)で溶解した血液検体から直接、DNAやRNAを増幅することが可能です。乾燥させた試薬入りの試験管に検体を入れ、携帯可能な電池式加熱装置を使って60℃の温度で45分間反応させ、その後、手作りのLED照射器を使用した検出器で感染の有無を判定します。まさに、フィールド調査で使用するのに最適な機器なのです。
 携帯用検査システムは、小型試験管やバッテリー、加熱装置、LED照射器などで構成される。高性能機器や施設を必要とせず、現地での診断が可能(キャプション和訳:左上から反時計回りに 加熱装置、バッテリー、LAMP検査試薬、検体用の試験管、LED照射器)
携帯用検査システムは、小型試験管やバッテリー、加熱装置、LED照射器などで構成される。高性能機器や施設を必要とせず、現地での診断が可能(キャプション和訳:左上から反時計回りに 加熱装置、バッテリー、LAMP検査試薬、検体用の試験管、LED照射器)中島さんや林田さんら北海道大学・人獣共通感染症国際共同研究所の研究者によって開発された診断キットは、各感染症の検出に適したプライマー(DNA複製時の起点となる短鎖RNAまたはDNA)さえ設計すれば、ウイルス、細菌、寄生虫が引き起こす様々な新興・再興感染症の診断に対応できます。ただ、最適なプライマーの設計は難しく、実験を重ねることが必要です。
感染の危険を承知でザンビアで研究
林田さんは、アフリカ睡眠病の感染者の調査を行うとともに、病原体を媒介するツェツェバエや野生動物、家畜のサーベイランスを行っています。「獣医学領域からアプローチすることで、どのように寄生トリパノソーマ原虫が自然界で拡散していくか、また、どの野生動物が感染しているかなどを解明したいと考えています」。この寄生原虫は、野生動物には危害を与えませんが、ヨーロッパ原種の家畜は発症させるといいます。
また、林田さんは、HATに感染しているツェツェバエが多い地域を特定した地図を作成するためにザンビアの奥地に出向き、ツェツェバエの採集調査も行っています。ツェツェバエに刺されることもよくあるそうですが、「恐怖は感じない」そうです。「すべてのツェツェバエが感染している訳ではありませんし、たとえ感染したハエに刺されたとしても、我々のキットを使ってすぐに診断できますから」と、気丈に語ってくれました。
 最新の医療機器が不足するザンビアで、林田さんは同僚とともに現地住民の検査を行う
最新の医療機器が不足するザンビアで、林田さんは同僚とともに現地住民の検査を行う多剤耐性結核の感染拡大を防ぐ
世界保健機関(WHO)によると、世界では毎年約1,000万人の新規結核感染者が報告され、140万人が亡くなっています。結核は、アフリカやアジアの諸国で感染者が多いのが特徴です。基本的にヒトの疾病ですが、象や猿がヒト由来の結核菌に感染することもあります。
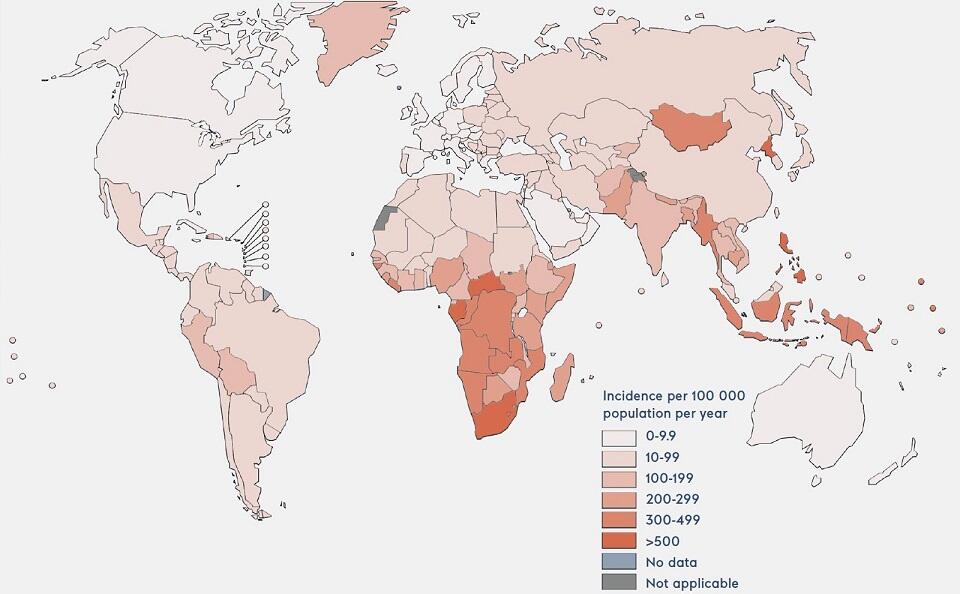 結核の推定感染率(WHOの2019年報告書から) 地図はWHOの「Global Tuberculosis Report 2020」から複製(キャプション和訳:人口10万人あたりの感染件数、データなし、対象外)
結核の推定感染率(WHOの2019年報告書から) 地図はWHOの「Global Tuberculosis Report 2020」から複製(キャプション和訳:人口10万人あたりの感染件数、データなし、対象外)「結核菌が増殖するペースは非常に遅く、治療薬を長期服用することによって結核は治すことができます。ところが、貧困層の患者は、6カ月の服用期間の途中で薬をやめてしまうことが多く、そのことが薬剤耐性の結核菌が出現する原因となります」と、中島さんは説明します。「結核菌の遺伝子に『点突然変異(1塩基置換)』が起こり、その結果関連する分子の構造が変化すると、薬剤耐性を獲得します。生存に有利な変異を獲得した菌は生き残っていくのです」。したがって、薬剤耐性菌がヒトからヒトへ感染して更なる変異を起こさないように早期の正確な診断が必要になってくると、中島さんは強調します。
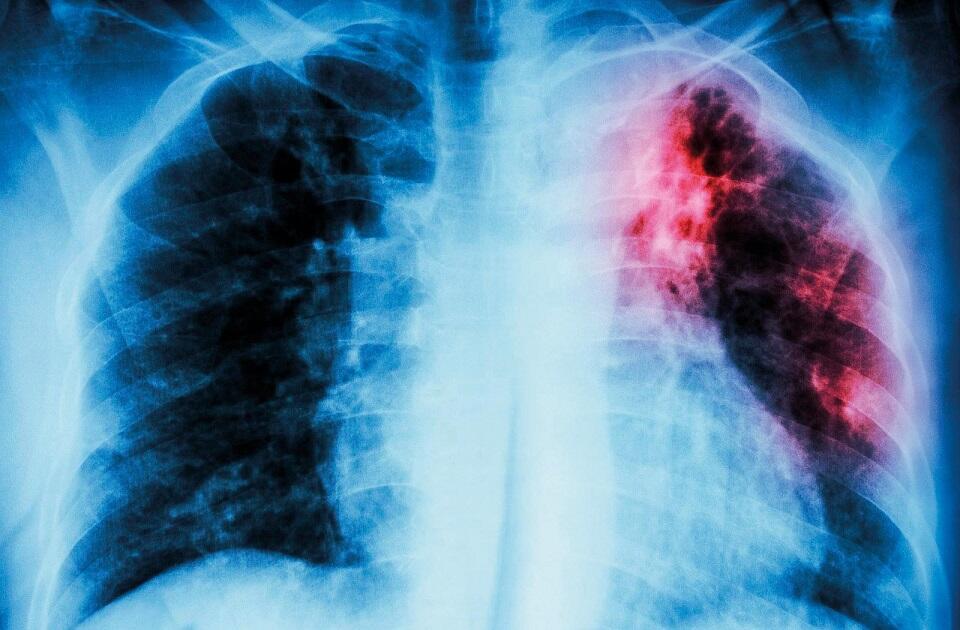 肺結核患者の胸部X線写真:結核菌感染により間質性浸潤が肺の左上に見られる(©️iStock)
肺結核患者の胸部X線写真:結核菌感染により間質性浸潤が肺の左上に見られる(©️iStock)そこで、中島さんが開発したのが、結核菌を検出するLAMPシステムと、菌型判別(スポリゴタイピング)に用いるDNAアレイ(多数のDNA断片を配列した分析ツール)です。通常のスポリゴタイピングは、取り扱いが複雑で高価ですが、中島さんの開発したDNAアレイは簡便に使用でき、1回3〜4米ドルほどの低コストです。
中島さんはさらに、株式会社TBAとの共同プロジェクトで、治療薬イソニアジドに耐性を持つ結核菌を検出できるPAS法(標的DNAを簡便に目視判別できる遺伝子検査方法)を開発したほか、アジアの国々で多剤耐性化しつつ急速に感染が広がっている結核菌「新興型北京株」を判別するPCR方法を確立しています。「危険な結核菌型を他の菌型から判別することにより、自ずと患者の治療優先順位がわかります。結核罹患者が多い国は通常、医療施設の対応能力は限られていますので、このような検査法が重要になってきます。ヒトからヒトへの感染を抑えることが大切なのです」と、中島さんは説明します。
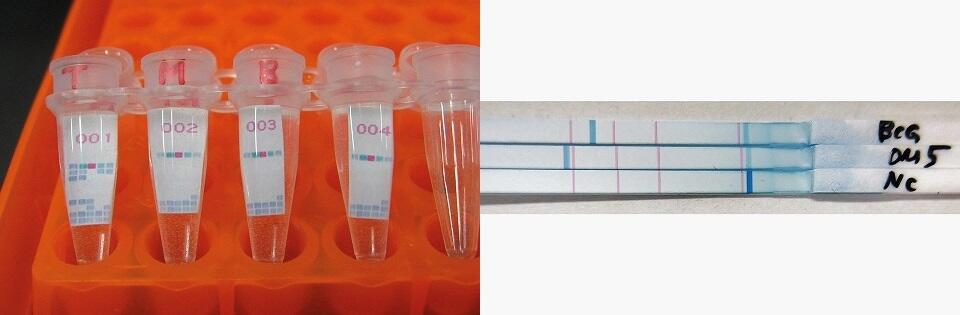 <左>中島さんらは、結核菌株の検出やその菌型を判別できる簡易スポリゴタイピングキットを開発
<左>中島さんらは、結核菌株の検出やその菌型を判別できる簡易スポリゴタイピングキットを開発 <右>PAS法は、イソニアジドに耐性を持つ結核菌を検出できる
現在、教育者として懸念しているのは、指導した留学生が「学んだ専門知識を活かせる仕事は自国にはほとんどない」といい、祖国に戻ることをためらうことです。「彼らの国の政府が、的確な感染症対策を行えるように支援をすることも、我々の責務です。私は自然科学が専門ですが、研究を進めることで他国の社会問題についても目を向けるようになりました」と中島さん。深刻な社会問題にも心を砕きながら、結核に対峙していく決意を語ってくれました。






