シリーズ「人獣共通感染症との戦い」の第6回。本シリーズでは、人獣共通感染症をはじめ、その他の新興・再興感染症を制御する北海道大学の取り組みを紹介していきます。
澤 洋文(医学博士)
北海道大学 人獣共通感染症国際共同研究所 副所長・教授
人獣共通感染症国際共同研究所国際展開推進部門(ザンビア拠点)拠点長
研究分野:分子生物学、ウイルス学、疫学、動物モデル
34年前、澤 洋文さんは本学の医学研究科で循環器医師として基礎研究を開始し、研究者としてのキャリアをスタートさせました。その後、ウイルス性疾患に興味を持ち、同大の長嶋和郎教授の下、JCウイルスという中枢神経系に脱髄性の疾患を引き起こすウイルスの研究を始めました。そのような背景もあり、澤さんが2005年に設立された人獣共通感染症リサーチセンター(現人獣共通感染症国際共同研究所、IIZC)の教授職に応募したのは、ごく自然の流れでした。
澤さんは年に3、4回、IIZCの研究室を離れ、ザンビアで蚊を採取したり、洞窟で野生動物や節足動物を捕まえたりするフィールド研究を実施しています。北海道大学の最先端の研究現場と、電気などのインフラが全くないアフリカ辺境の地とを行ったり来たりしているのです。
「私は、いつも興味の向く方向に進んできました。医師になったのは、病気で困っている方の力になろうと思ったからです。現在は人獣共通感染症の『先回り対策』を行っていますが、広い意味で、そのゴールは医師と同じです。ただ、同僚たちとは戦略が少し違うだけです」と、澤さんは語ります。
人獣共通感染症の新種ウイルスを発見
澤さんのザンビアでの研究拠点は、IIZCがザンビア大学獣医学部内に設立したザンビア拠点です。同拠点は、アフリカでの疫学調査を実施することを目的に、2007年に設立されました。
 コウモリの糞、および洞窟内の節足動物を採取するために洞窟に入る澤さんと共同研究者たち。挿入写真は、フルーツコウモリ(ストローオオコウモリ)
コウモリの糞、および洞窟内の節足動物を採取するために洞窟に入る澤さんと共同研究者たち。挿入写真は、フルーツコウモリ(ストローオオコウモリ)アフリカは感染症の研究を行う上で鍵となる地域です。公衆衛生に大きな脅威となる、ヒト免疫不全ウイルス(HIV)、エボラウイルス、ジカウイルスなどの病原体はアフリカ起源とされているほか、黄熱やマラリアもアフリカで蔓延しています。「人獣共通感染症を制御するには、既知、未知の感染症が発生する発展途上国で研究することが肝要です。感染症は撲滅するのが難しい。でも、エビデンスに基づいた先回り対策を行えば、人獣共通感染症が世界中に広がるのを防ぐことができます」と澤さん。
「そのためには、動物が保持するウイルスの多様性を解明し、さらに新種のウイルスを発見し、その宿主域や病原性、伝播経路を明らかにしなければなりません。7割以上の新興感染症が野生動物起源だということを考慮すれば、こうした調査はもっと注目されるべきです」
 げっ歯類動物が保有するウイルスを調査する様子
げっ歯類動物が保有するウイルスを調査する様子澤さんの研究チームは、今までに、野生動物や節足動物が保有する20の新種ウイルスの検出・分離に成功しています。ザンビアの野生ヒヒから、パラミクソウイルス科(麻疹ウイルスやおたふくかぜウイルスもこの科に属する)のウイルス遺伝子を検出したのは、研究チームメンバーの佐々木道仁さん(IIZC講師)でした。佐々木さんは、類似する塩基配列を幅広く検出できる方法を用い、ヒヒから検出したウイルスの一つがヒトパラインフルエンザウイルス3型(HPIV3)であることを見出しました。また、そのウイルスが、2009年に入院中のサウジアラビアの子どもから検出されたHPIV3株(Riyadh149/2009)に極めて近いことも明らかにしました。
「このウイルスはヒトからヒトへ感染した後、ヒトから他の動物に感染したと考えられます。ヒヒは食糧を求めて、ヒトの近くに寄ってくる傾向があります。この接触でヒヒからヒト、またはヒトからヒヒへのウイルス感染が起こると思われます」
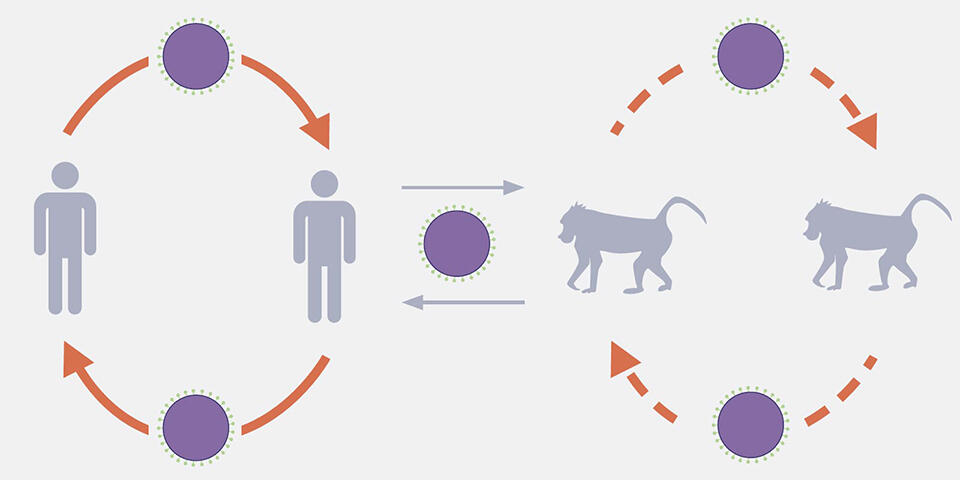 推定されるヒヒとヒト間のHPIV感染サイクル
推定されるヒヒとヒト間のHPIV感染サイクル次世代シーケンサーで包括的な遺伝子プロファイリングが可能に
澤さんによると、迅速かつ包括的にDNAやRNAの塩基配列を決定できる次世代シーケンサーの登場は、ゲノム生物学や分子生物学に革命的な変化をもたらしました。ウイルスのゲノムを検出するPCR検査は既知ウイルスを検査する場合に有用です。一方、次世代シーケンサーは未知のウイルスのゲノムを検出する場合に力を発揮します。次世代シーケンサーは、DNAウイルスやRNAウイルスを含む、未知の病原体の塩基配列決定を包括的に行うことができます。また、費用対効果も高いのが特徴です。
事実、次世代シーケンサーの発展は新種ウイルスの発見にも貢献しています。国際ウイルス分類委員会に登録されたウイルスは、2005年には1,898種でしたが、2020年5月には6,590種に急増しています。
ショットガンメタゲノミクスと呼ばれる最新技術も使われています。検体から抽出されたDNAやRNAをせん断し、次世代シーケンサーを使って、それらの破片の塩基配列を決定する方法です。この方法で得られた情報は、バイオインフォマティクス(生物情報科学)ツールを用いて分析されます。研究チームは、現地でウイルスを検出できる、携帯可能で便利なシーケンサーも使用しています。
 次世代シーケンサー
次世代シーケンサーこれらの最新技術を使い、研究チームはザンビアの洞窟に生息する昆虫食コウモリからA群ロタウイルスを検出しました。ロタウイルスは11分節からなる2本鎖RNA遺伝子を持っていますが、佐々木さんが見つけたロタウイルス遺伝子は、6分節がヒトロタウイルスと非常に類似性があり(96〜99パーセントの一致)、残る5分節は家畜や野生動物で検出されたロタウイルスに類似性が認められました。澤さんは、「結果を見ると、コウモリが保持するロタウイルスは、ヒトロタウイルスと似た遺伝子プロファイルを持っていて、種を超えた感染が起こっている証拠になります。ロタウイルスに遺伝子の多様性があるのは、おそらく遺伝子再集合が起こったからでしょう」と分析しています。
研究チームはさらに、ザンビアの住宅街で昆虫食ジネズミから複数の新種ウイルスを検出しています。ジネズミから検出したピコルナウイルス科の新種ウイルスは、ヒトに胃腸炎を発症させるヒトピコルナウイルスに類似性があるそうです。さらに、新種のシクロウイルスは、動物のフンに見つかる既知のシクロウイルス種とは大きな違いがあり、脳脊髄炎患者の脳脊髄液で見つかるウイルスに酷似しているといいます。「世界中に生息するジネズミは、固有のタイプのウイルスを持っています。今後、人獣共通感染症の宿主になり得ることを示唆しています」と、澤さんは警鐘を鳴らします。
野生動物から検体を集めてウイルスを分離するのは手間と時間がかかる作業ですが、澤さんは「人獣共通感染症との闘いには必要不可欠」と強調します。そのため、作業の短縮化に向けて、ウイルスの複製に最適な細胞を作成したり、その細胞とウイルスを一緒に回転培養するなど、ウイルス分離作業の効率化にも取り組んでいるそうです。
蚊は「最も危険な昆虫」
同じく研究チームメンバーの大場靖子さん(IIZC准教授)は、ウイルスを媒介する蚊の調査を行っています。澤さんによると、蚊は様々な疾病を媒介する「最も危険な昆虫」です。大場さんは2012〜2019年、ザンビア各地で17,800以上のメスの蚊を採取し、未知のウイルスを探しました。この調査では、ザンビアで初めてウエストナイルウイルスの分離に成功しました。ウエストナイルウイルスは蚊と鳥の間で感染が維持され、時にウマやヒトに感染し病気を引き起こすため、伝播経路である鳥、ヒトの感染についても調査しました。
 蚊の採取には、メスの蚊を引き寄せる匂いを発する罠や二酸化炭素を使用。挿入写真は、ウエストナイルウイルスを媒介することが判明した一般的な蚊(ネッタイイエカ)。
蚊の採取には、メスの蚊を引き寄せる匂いを発する罠や二酸化炭素を使用。挿入写真は、ウエストナイルウイルスを媒介することが判明した一般的な蚊(ネッタイイエカ)。澤さんは、「野生動物や節足動物、つまり自然宿主が保持するウイルスの多様性やウイルス病原性を研究することで、先回り対策はできます」と改めて指摘します。その一環として、現在、塩野義製薬の研究者でIIZC客員教授も兼務する佐藤彰彦さんと、節足動物媒介性ウイルス(アルボウイルス)やコロナウイルスを治療する抗ウイルス薬の開発も行っています。
「ヒトの循環器疾患の基礎研究をする医師が、まさかザンビアを訪れて感染症の研究をすることになるとは、夢にも思いませんでした。大変な部分もありますが、続けられたのは、やっぱりザンビアの方々が好きだからです。シャイですが、優しい方がとても多い」と言う澤さんは、今後もザンビアでの研究に注力していく予定です。
この記事の原文は英語です
Tackling Global Issues Vol.3 Fighting the Menace of Zoonosesに掲載





